Fala Gás Nobre, tudo bem? Preparado para reagir? Nesse artigo, vamos falar sobre Eletroquímica, através de um resumo com os principais tópicos, bem como resolver alguns exercícios sobre o tema.
Fique até o final do artigo, pois resolvi organizar os seus estudos, e recomendar aulas que eu tenho certeza que vão agregar valor ao texto que escrevi. Fico preocupado, pois nesses textos busco trazer uma informação bacana, para que você possa ficar por dentro de “temas quentes”, que são bastante abordados nos vestibulares, mas sempre tem “alguma coisinha” que pode ficar de fora. Por isso, fique até o final do artigo, pois tenho certeza que será de grande valia todo esse artigo.
Ah, e antes que me esqueça: esse tema cai BASTANTE no ENEM.
PILHAS E ELETRÓLISE
A Eletroquímica, de uma maneira geral, é uma área que investiga as reações químicas onde temos a transferência de elétrons, o que em outras palavras podemos chamar de reações de oxirredução. Essas reações, são aquelas caracterizadas pela variação do NOX dos participantes.
Inclusive, eu já escrevi dois artigos super interessantes sobre as reações de oxirredução, seus fundamentos e como é feito o balanceamento de uma equação. Se por acaso você não leu esses artigos, e não faz ideia do que vem ser uma reação de oxirredução, basta clicar aqui.

De maneira geral, dividimos o estudo da Eletroquímica através da investigação de como funcionam os processos das pilhas e eletrólise.
Você sabe como funciona uma pilha, e como é o processo de produção do alumínio metálico?
ESTUDO DAS PILHAS
As pilhas são dispositivos que se beneficiam de uma reação química espontânea de oxirredução, que geram a corrente elétrica que utilizamos. Nesse processo, temos um processo de oxidação ocorrendo em uma região da pilha chamada de ânodo (que é o pólo negativo), onde elétrons migram através de um fio condutor até o cátodo (que é o pólo positivo), região em que temos uma semi-reação de redução. A diferença de potencial (ddp) apresentará sempre valores positivos, o que configura uma reação espontânea.
As pilhas mais estudadas são as pilhas de Daniell.
Vamos analisar duas questões sobre esse tema?
(Enem cancelado 2009) Pilhas e baterias são dispositivos tão comuns em nossa sociedade que, sem percebermos, carregamos vários deles junto ao nosso corpo; elas estão presentes em aparelhos de MP3, relógios, rádios, celulares etc. As semirreações descritas a seguir ilustram o que ocorre em uma pilha de óxido de prata.
Zn(s) + OH–(aq) → ZnO(s) + H2O(l) + e–
Ag2O(s) + H2O(l) + e– → Ag(s) + OH–(aq)
Pode-se afirmar que esta pilha:
a) é uma pilha ácida.
b) apresenta o óxido de prata como o ânodo.
c) apresenta o zinco como o agente oxidante.
d) tem como reação da célula a seguinte reação: Zn(s) + Ag2O(s) → ZnO(s) + 2Ag(s).
e) apresenta fluxo de elétrons na pilha do eletrodo de Ag2O para o Zn.
Resolução:
Alternativa correta: D
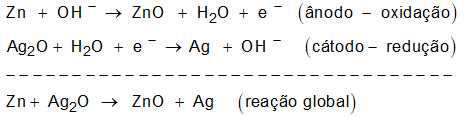
Comentários:
Alternativa A: Pelo fato da pilha apresentar íons OH–, temos uma pilha alcalina e não ácida;
Alternativa B: A região da pilha classificada como ânodo, é aquela onde há a perda de elétrons (oxidação), o que nesse caso seria o zinco metálico;
Alternativa C: O zinco seria considerado o agente redutor;
Alternativa E: O fluxo de elétrons de uma pilha é sempre do ânodo para o cátodo, nesse caso, do zinco para o óxido de prata.
(Enem 2012) O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma “lenda urbana”, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
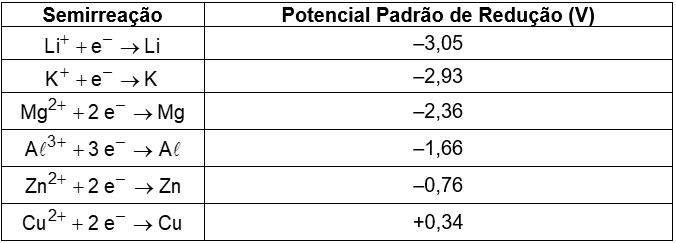
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
a) Somente o lítio, pois ele possui o menor potencial de redução.
b) Somente o cobre, pois ele possui o maior potencial de redução.
c) Somente o potássio, pois ele possui potencial de redução mais próximo do magnésio.
d) Somente o cobre e o zinco, pois eles sofrem oxidação mais facilmente que o alumínio.
e) Somente o lítio e o potássio, pois seus potenciais de redução são menores do que o do alumínio.
Resolução:
Alternativa correta: E
Os metais que poderiam entrar na composição do anel das latas com a mesma função do magnésio (ou seja, proteger o alumínio da oxidação) devem apresentar menores potenciais de redução do que o do alumínio e neste caso o lítio e o potássio se encaixam.

Por falar em pilhas, você sabe por que uma pilha pode estourar?
Caso não saiba, não deixe de ler esse artigo que escrevi para o blog. Clique aqui.
A ELETRÓLISE

Há reações que não ocorrem espontaneamente, através de um processo específico, damos uma “forcinha” para que possam ocorrer. Nas pilhas, vimos que uma reação química espontânea gera eletricidade. Na eletrólise, temos basicamente o contrário: a eletricidade gera uma reação espontânea.
A produção do alumínio metálico, soda cáustica, dentre tantos outros produtos, são possíveis por conta da Eletrólise.
A eletrólise é dividida em dois tipos: a eletrólise ígnea e a eletrólise aquosa.
Na eletrólise ígnea, temos ausência de água e necessidade de altas temperaturas que são as responsáveis por promover a fusão dos compostos iônicos, como por exemplo, o óxido de alumínio (Al2O3), usado na produção do alumínio metálico.
Além disso, os íons formados são “descarregados” durante o processo, onde teremos no cátodo da eletrólise a ocorrência de redução de um cátion (íon positivo), e no ânodo a oxidação de um ânion (íon negativo).
Como isso envolve várias equações, vamos analisar uma questão sobre isso?
(Enem PPL 2015) O alumínio é um metal bastante versátil, pois, a partir dele, podem-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida e eletrolisada a cerca de Há liberação do gás dióxido de carbono formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:
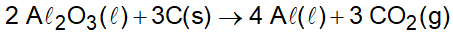
Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:
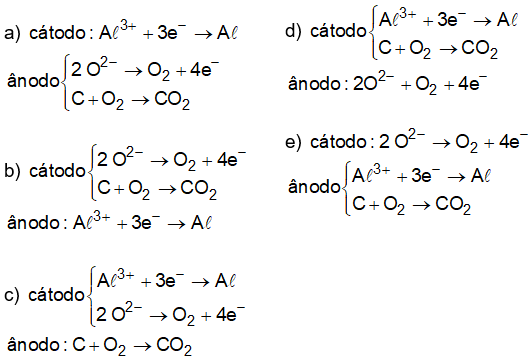
Resolução:
Alternativa correta: A
A partir da análise da equação fornecida no enunciado, vem:
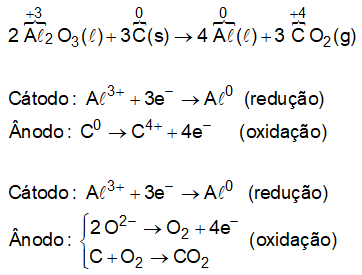
E na eletrólise aquosa?
Como o nome já diz, temos a presença de água, que é importante para que ocorra a dissociação iônica, e os íons possam ser descarregados. Diferentemente da eletrólise ígnea, na eletrólise aquosa temos que avaliar qual cátion e ânion serão descarregados, tendo em vista que a água se auto ioniza, gerando íons H+ e OH–.
Uma aplicação importante desse processo, é a eletrólise aquosa do cloreto de sódio, utilizado na produção da soda cáustica. Vamos analisar uma questão sobre isso?
(Enem 2017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
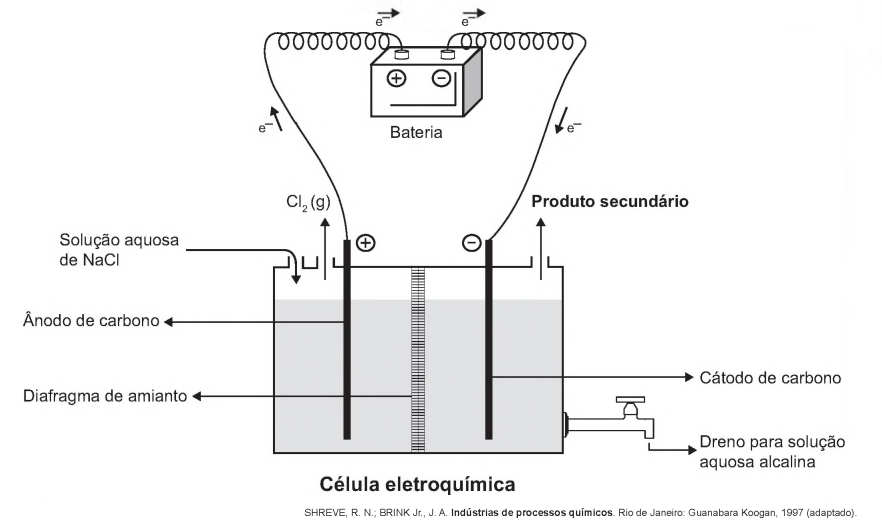
No processo eletrolítico ilustrado, o produto secundário obtido é o
a) vapor de água.
b) oxigênio molecular.
c) hipoclorito de sódio.
d) hidrogênio molecular.
e) cloreto de hidrogênio.
Resolução:
Alternativa correta: D
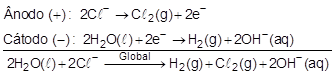
Gás Nobre, esse é um breve resumo contendo pontos importantes sobre esse tema. Ainda há muitos detalhes para serem discutidos. Imaginando que talvez você tenha uma necessidade de estudar o assunto de forma mais detalhada e com mais exemplos, logo abaixo segue recomendações de vídeos do nosso canal, com aulas que eu tenho certeza que você vai gostar.
Todo o assunto de eletroquímica poderá ser estudado através dessas aulas em vídeo 😀
Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


